Número actual.
Enero-Marzo 2026 vol. 77-1
Portada
Desde el Comité Editorial
Embarazo adolescente, una visión integral
El embarazo adolescente es un asunto de la familia, la escuela y el Estado
El papel de la dinámica familiar en el embarazo adolescente
La búsqueda de afecto y familia en el contexto del embarazo adolescente
Transformación de la identidad en el embarazo adolescente
Hormonas, metabolismo y bioquímica durante el embarazo de una adolescente
Las barreras que dificultan una buena lactancia en madres adolescentes
La importancia de la salud bucodental durante el embarazo de las adolescentes
Alimentación y hábitos saludables en las adolescentes embarazadas
La programación de la vida desde el vientre: nutrición, genética y epigenética
Mitos comunes sobre la anticoncepción tras el embarazo adolescente
Microorganismos que ayudan a descontaminar agua con arsénico
Marcadores moleculares del ADN: huellas genéticas que revelan secretos de los seres vivos
Noticias de la Academia Mexicana de Ciencias
La degradación ambiental de la Cuenca del Alto Atoyac y su impacto en la salud
Indice
Artículos del número anterior.
Las suculentas y la vista, una relación inesperada
Noticias de la Academia Mexicana de Ciencias
Desde las redes
Innovaciones tecnológicas en la uam: una mirada desde el doctorado
Tejiendo el futuro: nanotecnología en la industria textil
Las emociones en la toma de decisiones
Una nueva terapia para la leucemia linfoblástica aguda
Linfocitos T: desarrollo, activación y funciones
Paracetamol, un analgésico popular que no es tan inocuo
Entendiendo el tormento de la cefalea en racimos
“Obesos sanos”, un término equivocado
¿Nos predisponen los genes al consumo de drogas?
El rábano: de lo comestible a lo nanotecnológico
Portada
El romero, una planta para el alivio del dolor
Alfred Wallace: científico y militante social
¿Cómo reducir los gases de efecto invernadero de los rumiantes?
La Sierra de Guadalupe, una fuente de biodiversidad en la Cuenca de México
La unión hace la fuerza: historia de los líquenes
Los dientes, una importante fuente de información morfológica y ecológica
Tejer o no tejer... Las diversas estrategias de caza de las arañas
El control de la temperatura corporal: cuestión de vida o muerte
Relojes moleculares: ¿cuándo aparecieron las especies?
Desde el Comité Editorial
Indice
Desde el punto de vista evolutivo, la reproducción es el propósito fundamental de la vida; en este sentido, la evolución ha sido verdaderamente creativa. Existen dos grandes grupos de organismos, los de reproducción sexual y los asexuales. Dentro del primero, la mayoría de las especies se dividen en dos sexos; sin embargo existen especies que tienen más de dos.
Para determinar el sexo de un organismo hay una gran variedad de mecanismos y estrategias. Entre ellos se encuentran la determinación del sexo por la temperatura a la cual se desarrolla el embrión, por el balance entre machos y hembras que existe en la vecindad, por el tamaño de un individuo con respecto a su pareja, por la presencia de uno o varios genes, por la cantidad de ciertos genes con respecto a otros, etcétera. En esta revisión nos enfocaremos a lo que se conoce sobre la reproducción y determinación sexual en mamíferos.
Los mamíferos nos reproducimos sexualmente, y generalmente tenemos sólo dos sexos. Cada sexo produce un tipo específico de gameto (ovocito y espermatozoide) y se requiere la fusión de ambos para generar a un nuevo individuo. Así como la naturaleza ha sido creativa para establecer los diversos mecanismos de determinación sexual, los humanos hemos sido creativos en la generación de ideas para explicar cómo se determina el sexo. Aristóteles creía que entre más calor hubiera durante la cópula, más probabilidades habría de tener varones. Anaxágoras creía que el semen del testículo derecho producía machos, mientras que el del izquierdo producía hembras (idea tan influyente que incluso siglos más tarde algunos aristócratas franceses se hicieron amputar el testículo izquierdo para asegurar descendencia varonil). Y en el siglo antepasado se consideraba que los niños provenían de ovocitos descargados del ovario derecho, mientras que las niñas de ovocitos del ovario izquierdo. También se ha creído que son factores nutricionales los que determinan el sexo, proponiéndose un sinnúmero de dietas para la obtención de descendencia de uno u otro sexo. En el último siglo, con al avance en la citología, la genética y la biología molecular, se pudo finalmente dar respuesta con bases científicas a esta pregunta, y hoy sabemos que esta determinación está dada por componentes genéticos.
| En el humano, los primordios gonadales (tejidos que dan origen a los testículos u ovarios) son estructuralmente idénticos en machos y hembras hasta alrededor de la séptima semana de embarazo |  |
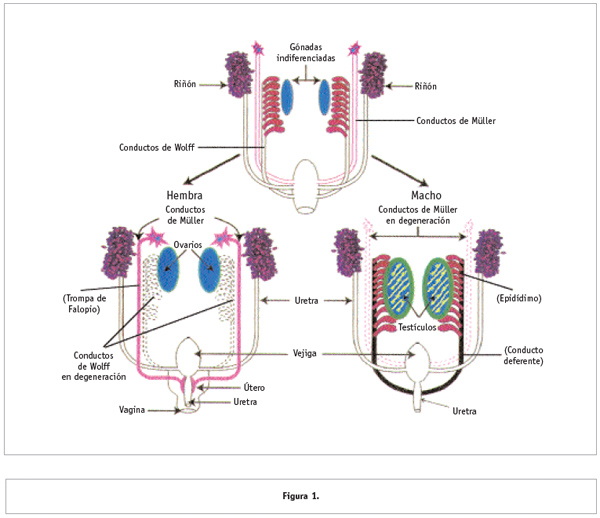
Desarrollo del tracto reproductor en los mamíferos
La diferencia fundamental entre machos y hembras es que los primeros tienen testículos y las segundas ovarios. Sin embargo, esta diferencia no existe desde el momento de la fecundación, sino que se genera en etapas más avanzadas del desarrollo (Figura 1). En el humano, los primordios gonadales (tejidos que dan origen a los testículos u ovarios) son estructuralmente idénticos en machos y hembras hasta alrededor de la séptima semana de embarazo (lo que en el ratón equivale a los 11.5 días de gestación). Días más tarde (en ratón, a los 12.5 días de gestación), los testículos empiezan a ser distinguibles por la formación de los llamados cordones testiculares, que más tarde formarán los llamados tubos seminíferos. En las hembras, las gónadas permanecen sin cambios morfológicos por más tiempo: su transformación en ovario no es apreciable sino hasta días más tarde, cuando sus células germinales entran en el proceso de división celular conocido como meiosis, como veremos más adelante.
Las gónadas están compuestas por tres diferentes tipos celulares:
1) Las células de “soporte”, conocidas en el macho como células de Sertoli y en la hembra como células de la granulosa.
2) Las células productoras de esteroides, denominadas en el macho células de Leydig, y en la hembra células de la teca.
3) Las células germinales, que en el macho dan origen a los espermatozoides y en la hembra a los ovocitos.
Además de las gónadas, otras diferencias sexuales se dan en los conductos sexuales por los cuales los gametos salen de las gónadas. En el caso de los machos, éstos son el conducto eferente, el epidídimo y el conducto deferente, los cuales se originan a partir del conducto de Wolff. En hembras, el conducto de Müller origina al oviducto (o trompas de Falopio) y al útero.
El conducto de Wolff y el conducto de Müller se desarrollan tanto en embriones hembra como en macho; sin embargo, dependiendo del tipo de gónada que se forme, uno de los dos conductos desaparece. En machos, la hormona antimülleriana producida por las células de Sertoli en el testículo provoca la degeneración de los conductos de Müller. Por otro lado, la testosterona producida por las células de Leydig promueve el desarrollo y masculinización de los conductos de Wolff. En hembras, los conductos de Wolff se degeneran por la ausencia de testosterona mientras que los de Müller se mantienen, ya que no hay producción de hormona antimülleriana (Figura 1).
Bases genéticas de la determinación sexual
Hace un poco más de cien años se observó que las hembras y los machos de algunos insectos tenían diferente número de cromosomas. Las hembras tenían 24, los cuales durante la meiosis se apareaban en 12 pares, y los machos tenían 23, los cuales se apareaban en 11 pares, quedando un cromosoma solitario. A este cromosoma solitario se le llamó cromosoma accesorio o cromosoma X. En 1901 se propuso que este cromosoma X era el que determinaba el sexo; por primera vez se proponían bases genéticas a la determinación sexual.
En los mamíferos la determinación primaria del sexo es estrictamente cromosomal, y en la mayoría de los casos un individuo con dos cromosomas sexuales XX será hembra, mientras que con un cromosoma sexual X y otro Y (XY) será macho. En 1947, el doctor Jost había castrado a embriones de conejo que se encontraban todavía en el útero de la madre, dejando que su desarrollo procediera hasta el nacimiento. Observó que todos nacían con características sexuales de hembra sin importar si sus cromosomas eran XY o XX, por lo que propuso que la determinación sexual del individuo está controlada por la diferenciación y presencia del testículo. Sin embargo, en 1959 se estableció que, en mamíferos, el cromosoma Y era el inductor dominante de las características masculinas (o fenotipo masculino), ya que en su presencia, sin importar el número de cromosomas X, el desarrollo era de macho. Dado que el cromosoma Y es el inductor dominante del fenotipo masculino, se concluyó que en él debía existir un “factor determinante del testículo”.
| En 1959 se estableció que, en mamíferos, el cromosoma Y era el inductor dominante de las características masculinas ya que en su presencia, sin importar el número de cromosomas X, el desarrollo era de macho |
Así se inició una larga búsqueda de este factor, que concluyó en 1991 con la identificación del gen Sry, el único dentro del cromosoma Y que se necesita para la determinación del testículo. Esto se demostró al introducir un fragmento de ADN que contenía exclusivamente al gen Sry en embriones de ratón XX, ocasionando que los individuos se desarrollaran como machos (Koopman y colaboradores, 1991).
Cascada de genes involucrados en la determinación sexual
Una vez localizado al factor determinante del testículo, se creyó que sería fácil dilucidar el resto del mecanismo de determinación sexual. Sin embargo, a 16 años de su descubrimiento, todavía no es claro cómo funciona este gen. El Sry se expresa justo antes de la diferenciación del testículo, y su expresión es transitoria, apagándose en alrededor de 24 horas. La proteína Sry es capaz de unirse al ADN, por lo que se cree que actúa como factor transcripcional (es decir, que regula a otros genes) iniciando así una cascada de señales que finaliza con la formación del testículo. Aparte de su función como regulador de la expresión de otros genes, recientemente se observó que Sry podría participar también en el mecanismo de empalme de los arns mensajeros, moléculas a partir de las cuales se sintetizan las proteínas (Ohe y colaboradores, 2002).
El mecanismo de empalme consiste en la eliminación de algunos fragmentos del ARN (tal como es copiado originalmente del ADN), por lo que a partir de un mismo ARN se pueden producir diferentes proteínas a través de la formación de arns mensajeros alternativos. En la mosca de la fruta Drosophila melanogaster la cascada de determinación sexual se da justamente a través de este mecanismo.
Excepto por un pequeño segmento, las proteínas Sry de distintos mamíferos no son muy parecidas entre sí. Por ejemplo, en ratón, en un extremo de la molécula hay muchas repeticiones de los aminoácidos glutamina e histidina, las cuales no se encuentran en la proteína de humano. Sorprendentemente, el número de repeticiones difiere entre las distintas cepas de ratón; su función no es clara. En cuanto a la organización del testículo, se ha visto que la expresión de Sry induce la proliferación de las células de Sertoli y la migración de las llamadas células mioides peritubulares hacia el testículo, las cuales forman una barrera entre las células del estroma y las células germinales y de Sertoli. Actualmente, uno de los principales objetivos de esta área de estudio es encontrar los genes que son regulados directamente por Sry y clarificar su función en el maduración de los arns mensajeros.
Además del Sry, se conocen otros genes que participan en la determinación sexual. Éstos generalmente se han identificado por mutaciones o cambios que causan reversión sexual, o porque tienen distinta expresión en machos y hembras. Dentro de estos genes se encuentra Sox9. Este gen es de la misma familia que el Sry, ya que la proteína que produce tiene un dominio de unión al ADN muy parecido al de éste. En humano, las mutaciones en Sox9 causan un padecimiento conocido como displasia campomélica congénita, el cual se caracteriza por la presencia de problemas esqueléticos, además de que individuos XY se desarrollan como hembras. Esto hace suponer que Sox9 está fuertemente implicado en la determinación del sexo masculino. Tanto la duplicación de este gen (en humanos), como las mutaciones (en ratón) que aumenta su expresión, originan que individuos XX se desarrollen como machos.
En ratón se ha visto que Sox9 se expresa en la gónada masculina poco después de haberse expresado el gen Sry, por lo que se ha argumentado que Sox9 pudiera ser un blanco directo de éste. Sin embargo sólo existen evidencias circunstanciales para apoyar esto. Es interesante que Sox9 se encuentre también expresado en células de Sertoli de testículos de aves (donde el macho es el homogamético, XX) y en reptiles (donde el sexo se determina por la temperatura de incubación de los huevos; Moreno-Mendoza y colaboradores, 1999). Por otro lado, existen evidencias que indican que se requiere Sox9 para activar a la hormona antimülleriana, lo que conecta a este gen con el resto de la cascada de diferenciación sexual. Todo esto sugiere que aparte del Sry, Sox9 es un gen crítico y necesario para la determinación del testículo, no sólo en mamíferos, sino en vertebrados en general.
| Aparte del Sry, Sox9 es un gen crítico y necesario para la determinación del testículo, no sólo en mamíferos, sino en vertebrados en general |  |
A pesar de que la determinación sexual es muy distinta entre organismos, existe un ejemplo en donde genes relacionados estructural y funcionalmente controlan el desarrollo sexual en diferentes grupos. Éstos son el gen doublesex, en la mosca Drosophila, y el gen mab-3, en el gusano nemátodo Caenorhabditis elegans. Ambos tienen un componente de unión al DM conocido como dominio DM y, entre otras cosas, controlan la diferenciación sexo-específica de neuroblastos. La forma masculina de doublesex puede sustituir a mab-3 en C. elegans. En mamíferos se han encontrado varios genes con el dominio dm, los cuales pudieran estar involucrados en el desarrollo sexual. Dmrt1 se expresa en gónadas indiferenciadas, aumentando su expresión en testículo, tanto en células de Sertoli como en células germinales, y apagando su expresión en ovarios. Se ha visto que este gen también se requiere para la diferenciación del testículo (Raymond y colaboradores, 2000). Otros miembros de esta familia de genes también presentan expresión diferencial. Dmrt3 se expresa principalmente en machos, mientras que Dmrt7 lo hace en hembras. Por lo tanto, esta familia de genes puede representar una forma ancestral de los mecanismos de determinación sexual sobre la cual evolucionaron otras. Será muy importante encontrar los mecanismos de regulación y las funciones de esta familia de genes.
| Se conoce todavía muy poco respecto a la determinación y el desarrollo del ovario. Hasta hace poco se había considerado que se desarrollaba pasivamente y que no se requería de ninguna señal para convertirse en ovario, por ser éste el camino predeterminado de desarrollo |
 Se conoce todavía muy poco respecto a la determinación y el desarrollo del ovario. Hasta hace poco se había considerado que se desarrollaba pasivamente y que no se requería de ninguna señal para convertirse en ovario, por ser éste el camino predeterminado de desarrollo. Sin embargo, se encontró un gen (Dax1) que puede estar directamente relacionado con su determinación y desarrollo. Dax1 se encuentra en el cromosoma X. En humano, pacientes con cromosomas XY que tienen duplicada la región del cromosoma X en donde se encuentra Dax1 tienen aspecto (fenotipo) de hembras, aun cuando posean un gen SRY funcional. Dax1 se expresa diferencialmente en los ovarios durante la etapa embrionaria, además de expresarse en tejidos involucrados en la síntesis de hormonas esteroides. En ratones transgénicos en los que la expresión de Dax1 está aumentada (debido a que su genoma se modificó introduciendo más copias del gen Dax1), se evita la reversión sexual que causa el gen Sry en individuos XX. Estas evidencias sugieren que el gen Dax1 funciona como un antagonista de la actividad del gen Sry (Swain y colaboradores, 1998). Sin embargo, sorprendentemente se encontró que ratones que no tienen ninguna copia funcional de este gen tienen un desarrollo normal del ovario, aunque tienen, en cambio, afectado el desarrollo del testículo (Meeks y colaboradores, 2003). En estos ratones se observó que la actividad de la aromatasa (enzima que convierte la testosterona en estradiol) está aumentada, por lo que el efecto en el desarrollo de los testículos pudiera deberse a un exceso de estrógenos. Por otro lado se ha argumentado que, en el modelo con ratones transgénicos, la expresión incrementada de Dax1 podría desencadenar vías de desarrollo que normalmente no estarían activas. En todo caso, lo que es evidente es que la formación adecuada de la gónada es sumamente sensible a los diferentes niveles y tiempos de expresión de Dax1. Se requerirán más estudios para entender el papel de este gen dentro de la cascada de determinación sexual.
Se conoce todavía muy poco respecto a la determinación y el desarrollo del ovario. Hasta hace poco se había considerado que se desarrollaba pasivamente y que no se requería de ninguna señal para convertirse en ovario, por ser éste el camino predeterminado de desarrollo. Sin embargo, se encontró un gen (Dax1) que puede estar directamente relacionado con su determinación y desarrollo. Dax1 se encuentra en el cromosoma X. En humano, pacientes con cromosomas XY que tienen duplicada la región del cromosoma X en donde se encuentra Dax1 tienen aspecto (fenotipo) de hembras, aun cuando posean un gen SRY funcional. Dax1 se expresa diferencialmente en los ovarios durante la etapa embrionaria, además de expresarse en tejidos involucrados en la síntesis de hormonas esteroides. En ratones transgénicos en los que la expresión de Dax1 está aumentada (debido a que su genoma se modificó introduciendo más copias del gen Dax1), se evita la reversión sexual que causa el gen Sry en individuos XX. Estas evidencias sugieren que el gen Dax1 funciona como un antagonista de la actividad del gen Sry (Swain y colaboradores, 1998). Sin embargo, sorprendentemente se encontró que ratones que no tienen ninguna copia funcional de este gen tienen un desarrollo normal del ovario, aunque tienen, en cambio, afectado el desarrollo del testículo (Meeks y colaboradores, 2003). En estos ratones se observó que la actividad de la aromatasa (enzima que convierte la testosterona en estradiol) está aumentada, por lo que el efecto en el desarrollo de los testículos pudiera deberse a un exceso de estrógenos. Por otro lado se ha argumentado que, en el modelo con ratones transgénicos, la expresión incrementada de Dax1 podría desencadenar vías de desarrollo que normalmente no estarían activas. En todo caso, lo que es evidente es que la formación adecuada de la gónada es sumamente sensible a los diferentes niveles y tiempos de expresión de Dax1. Se requerirán más estudios para entender el papel de este gen dentro de la cascada de determinación sexual.
En conclusión, parece que el establecimiento adecuado del sexo se logra a través de un balance muy fino entre diversos factores. Observamos que la lucha por establecer el sexo lleva a la rápida evolución de estrategias que se van sobreponiendo a las ya existentes, creándose cascadas de regulación genética cada vez más sofisticadas. Es muy interesante que entre más descendemos por la cascada de determinación sexual, encontramos genes que se conservan en las cascadas de determinación sexual de otros organismos, como Sox9 y Dmrt1. En cambio, los pasos iniciales de la cascada están muy poco conservados y existe una gran variación entre organismos, desde la variación en cuanto al factor que determina el sexo, hasta la gran variedad que existe dentro de un mismo gen, como el Sry, que aun dentro del mismo grupo de organismos es sumamente variado.
Determinación y desarrollo de línea germinal: importancia de la línea germinal
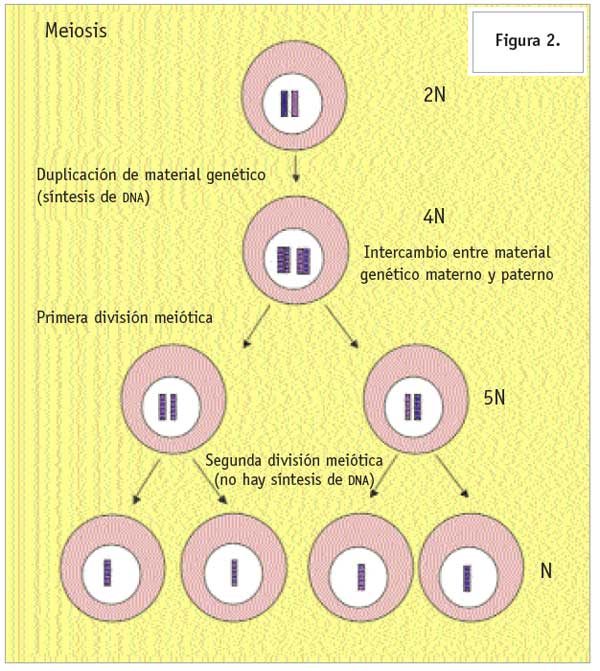
Las células germinales primordiales son las precursoras de los gametos femeninos y masculinos, óvulo y espermatozoides, respectivamente. La relevancia biológica de este tipo celular se hace evidente cuando pensamos que son estas células las que nos permiten preservar a las especies e incrementar la variabilidad genética de las mismas, mediante la formación de nuevos individuos. Las células germinales primordiales son las únicas que llevan a cabo un proceso de división celular muy particular conocido como meiosis. Las células somáticas (todas las que forman el organismo, excepto los óvulos y espermatozoides) tienen dos copias del genoma (son diploides): una copia de origen materno y la otra de origen paterno. Para dividirse, cada célula duplica previamente su material genético, por lo que transitoriamente tiene cuatro copias de material genético (es tetraploide). Finalmente, cuando la célula se divide en dos, cada célula somática “hija” se queda con la mitad del material genético, por lo que será nuevamente diploide. Esto se conoce como mitosis. En contraste, la meiosis consiste en formar células con una sola copia del genoma (haploides) a partir de una célula diploide. La meiosis consta de dos fases sucesivas (Figura 2). En la primera fase, una célula germinal diploide que inicia la meiosis también duplica su material genético, convirtiéndose transitoriamente en tetraploide, y al dividirse da origen a dos células diploides. Esto es similar a lo que ocurre para la división mitótica; sin embargo, durante la primera fase de la meiosis ocurre además un evento particular de este proceso previo a la división celular: el intercambio de segmentos equivalentes entre las copias homólogas de los cromosomas. Este evento da lugar a un incremento en la variabilidad genética de los gametos a formar, pues mezcla características de origen paterno y materno. Las células que salen de la primera división meiótica, diploides, entran en la segunda fase de la meiosis, caracterizada por la división de su material genético seguida de una división celular, sin que haya síntesis previa de material genético, por lo que al final cada célula posee una sola copia del genoma (es haploide). Así que por cada célula germinal diploide que inicie la meiosis deberán obtenerse cuatro células haploides. En el caso de la línea germinal masculina, cada célula germinal diploide origina cuatro espermatozoides funcionales. En contraste, en la línea germinal femenina, sólo una de las cuatro células haploides formadas da lugar a un ovocito funcional, pues las otras tres ceden todos sus nutrientes a ésta. ¿Cómo es que dentro de todas las células que constituyen a un individuo se determina cuales contribuirán a la formación de las células germinales primordiales? ¿Y cómo se determina su diferenciación en ovocitos o espermatozoides?
| Las células somáticas (todas las que forman el organismo, excepto los óvulos y espermatozoides) tienen dos copias del genoma (son diploides): una copia de origen materno y la otra de origen paterno |
Establecimiento de la línea germinal
En anfibios y peces, componentes citoplasmáticos del huevo (llamados plasma germinal) determinan tempranamente en el desarrollo cómo y dónde se formarán las células germinales primordiales (en algunos casos incluso antes de la fertilización). En contraste, en los mamíferos no parece haber determinantes citoplásmicos que definan a este tipo celular y su determinación se realiza relativamente tarde en el desarrollo. Actualmente sabemos que en el ratón la combinación de información provista por un determinado microambiente es lo que determina su línea germinal.
En el ratón, las células germinales primordiales se determinan alrededor del día 7.25 de gestación, en la base del alantoides, una estructura extraembrionaria localizada en la región posterior del embrión, de la cual derivará el cordón umbilical. Se demostró, con experimentos muy elegantes de transplantes de regiones del embrión, que es un microambiente muy particular localizado en esta región lo que permite que se originen o especifiquen las células germinales primordiales. Dentro de las moléculas que se han identificado como críticas en este proceso están las denominadas proteínas morfogenéticas de hueso. La deficiencia o reducción de ciertas proteínas de esta clase, denominadas Bmp4 y Bmp8, en los embriones de ratón tiene un efecto perjudicial sobre la formación o supervivencia de las células germinales primordiales (Ying y colaboradores, 2001). Recientemente se ha postulado que un grupo de proteínas transmembranales inducidas por el interferón, así como la proteína pgc7, codificada por el gen stella, pudieran también participar en el establecimiento de las células germinales primordiales. Dentro del primer grupo se ha identificado a la proteína fragilis como potencialmente involucrada en la formación y mantenimiento del fenotipo germinal por su expresión abundante en células germinales primordiales tempranas. Sin embargo, aún queda por establecer el papel funcional de dicha proteína o sus similares en la determinación y mantenimiento del fenotipo germinal. Por su parte, la proteína pgc7 parece ser el marcador más temprano de las CGP recién especificadas. Pgc7 es una proteína que no se parece a ninguna otra conocida; su función se desconoce aunque hay evidencia de que puede funcionar como un regulador de la síntesis de proteínas. Su expresión está restringida a embriones antes de la implantación y células germinales, lo que la hace un fuerte candidato para especificar y mantener el fenotipo germinal. Hay que esperar, sin embargo, estudios que indiquen claramente su función en la biología de la línea germinal.
Llegando a casa
Como mencionamos anteriormente, el microambiente particular que determina el lugar de formación y número inicial de las células germinales primordiales está en una estructura que se encuentra realmente fuera del embrión. Sin embargo, conforme avanza el desarrollo y se forman nuevas estructuras, las células germinales primordiales son introducidas al intestino en formación. Posteriormente, las células germinales primordiales se mueven activamente para dejar el intestino y dirigirse hacia la gónada indiferenciada del embrión. Para reconocer su destino, las células germinales primordiales usan pistas que incluyen proteínas depositadas en los espacios extracelulares, las cuales marcan un camino predeterminado. Estos eventos parecen combinarse con un movimiento dirigido hacia la gónada en formación debido a que ésta posiblemente produce sustancias que atraen a las células germinales primordiales.
Las integrinas son proteínas de la superficie de la célula que reconocen a proteínas del espacio extracelular. Se ha demostrado que la mutación de un tipo particular de integrinas, la integrina b1, afecta la migración de las células germinales primordiales hacia la gónada, lo que apoya la idea de que este tipo de células utilizan proteínas de la matriz extracelular para lograr colonizar la gónada (Anderson y colaboradores, 1999). Adicionalmente, una serie de moléculas secretadas por las gónadas o sus correspondientes receptores también afectan la migración y supervivencia de estas células. Un ejemplo es el sistema steel/c-kit. Steel es un factor que es secretado por las células de la gónada en formación, y se ha sugerido que produce un gradiente de concentración (Kinashi y Springer, 1994). Dicho gradiente parece ser detectado por las células germinales primordiales por medio de la unión de este factor a su receptor c-kit, que es expresado en la superficie de las células germinales primordiales. Se sugiere que las células germinales primordiales se mueven en dirección a la concentración creciente del factor steel. La deficiencia del factor steel o de su receptor tiene como resultado una disminución en el número de células germinales primordiales que colonizan la gónada. En estudios in vitro se ha observado que steel funciona también como un potente factor de sobrevivencia. Es probable que el efecto de steel en dirigir a las células germinales primordiales hacia la gónada esté dado principalmente por la estimulación de su supervivencia, de manera que las células germinales primordiales que han migrado en dirección de dicho factor se mantienen viables.
Otro de los sistemas recientemente descritos es el del factor SDF1 y su receptor CXCR4 (Molyneaux y colaboradores, 2003). De manera análoga al sistema anteriormente descrito, el factor SDF1 es expresado en las paredes del cuerpo y en la cresta genital, mientras que las células germinales primordiales expresan a CXCR4 en su superficie. Igualmente, la deficiencia de alguna de las dos proteínas tiene efectos sobre la dirección y supervivencia de las células germinales primordiales. Sin embargo, en este caso parece que el efecto de direccionalidad es más fuerte que su efecto en la supervivencia. No sería sorprendente que la dirección de la migración esté controlada por una combinación de sistemas que les asegure llegar a su destino. En el ratón, se ha calculado que el número inicial de células germinales primordiales es de alrededor de 50 células a los 7.5 días de gestación. Entre este momento y hasta que ya han colonizado las gónadas, se calcula que aumentan hasta en alrededor de 23 mil células germinales en un embrión de 13 días de gestación.
 Desarrollo sexual dimórfico de las células germinales primordiales: ovogénesis vs.
Desarrollo sexual dimórfico de las células germinales primordiales: ovogénesis vs.
espermatogénesis
De manera análoga a la gónada indiferenciada, que tiene la bipotencialidad de convertirse en un ovario o un testículo, dependiendo de su contexto genético, las células germinales primordiales tienen la potencialidad de convertirse en ovocitos o en espermatogonias. En este caso el ambiente juega un papel fundamental para determinar las características sexuales de las células germinales. Las células germinales primordiales en un ovario dejan de dividirse por mitosis e inician la primera fase de la meiosis. Dado que cuando están fuera de la gónada las células germinales primordiales son capaces de iniciar la meiosis, se había postulado que estas células están programadas para seguir la ruta de desarrollo hacia la ovogénesis sin la necesidad de algún factor inductor de este programa. Por el contrario, cuando células germinales primordiales (sin importar si su contenido genético es XX o XY) entran a un testículo embrionario, no inician la meiosis, sino que dejan de dividirse. Esto enfatiza la importancia del ambiente testicular somático en la determinación sexual de las células germinales, lo que ha llevado a proponer que moléculas producidas por las células somáticas del testículo embrionario (como parte de la casada de diferenciación desencadenada por el Sry) son capaces de dirigir activamente la ruta de diferenciación de las células germinales primordiales en sentido masculino. Recientemente se ha descubierto que la regulación de los niveles de una sustancia conocida como ácido retinóico es el mecanismo mediante el cual se establece el fenotipo sexual de las células germinales primordiales. La expresión en el testículo fetal de una enzima que degrada al ácido retinóico es la responsable de que las células germinales se diferencien en sentido masculino.
Dado que el objetivo principal de esta revisión es la determinación sexual, en adelante sólo mencionaremos algunos aspectos generales que son consecuencia del desarrollo temprano de la línea germinal. Los ovocitos en un ovario, además de iniciar la meiosis, pasan por una serie de procesos fundamentales. Uno de los más significativos es la acumulación de proteínas y arns que serán requeridos para el desarrollo temprano de un nuevo individuo en el caso de ser fertilizado por un espermatozoide. Durante esta etapa de maduración, el ovocito se rodea de una capa de células y una capa de glucoproteínas que son importantes para el reconocimiento por parte del espermatozoide y para el vaciado del acrosoma (ver adelante). Por otro lado, una proporción de los ovocitos mueren de manera programada y así proveen señales que se requieren para la diferenciación de los tejidos que producen hormonas en el ovario. Vale la pena hacer énfasis en un aspecto particular: como recordaremos, las células germinales primordiales en un individuo XX proliferan hasta que llegan a la gónada e inician la meiosis. Como de cada una de las células germinales primordiales diploide sólo se obtiene un ovocito funcional, esto implica que el número de potenciales ovocitos está limitado al número de células germinales que llegaron a las gónadas. A esta población habrá que restarle la de los ovocitos que mueren como parte de su programa de desarrollo o porque poseen mutaciones que son incompatibles con la vida, lo que nos deja con menor número de potenciales ovocitos. Para cuando una hembra llega a la pubertad, lo hace con un número limitado de ovocitos capaces de ser fertilizados. Además, conforme envejece la hembra también lo hacen sus ovocitos, por lo que tienen más tiempo para acumular mutaciones. Es por esto que la probabilidad de tener un hijo con algún defecto congénito aumenta con la edad de la mujer. En contraste, aunque un número similar de células germinales llegan a un testículo embrionario, durante la pubertad, las células germinales que carecían de división celular (proespermatogonias), vuelven a multiplicarse mediante división mitótica, y lo hacen así casi por el resto de la vida del individuo. Esto tiene como consecuencia que las poblaciones precursoras de espermatozoides se renueven constantemente, y que en caso de que alguna de estas células tenga una mutación perjudicial, pueda ser reparada o desechada sin tener ningún efecto significativo. Después de varias divisiones mitóticas las proespermatogonias inician la meiosis y proceden en su programa de diferenciación hacia espermatozoides. Con ayuda de las células de Sertoli, los ahora llamados espermatocitos pierden casi la totalidad de su citoplasma, desarrollan un aparato flagelar que los convierte en células muy móviles y desarrollan un organelo especializado (el acrosoma) en el que almacenan proteínas que se requieren para degradar las envolturas que cubren al ovocito, previo al proceso de fertilización. La mitad de los espermatozoides formados contendrán un cromosoma sexual X y la otra mitad uno Y. Es por esto que el macho es el que determina el sexo del individuo a formar dependiendo si su espermatozoide contribuye con un cromosoma X o uno Y.
El estudio del sexo en México
La importancia del estudio de la determinación sexual somática y gamética es evidente cuando nos damos cuenta del impacto biológico y evolutivo de dichos mecanismos. Esto ha impulsado a un significativo número de grupos en México a estudiar diversos aspectos de la determinación sexual y el desarrollo de la línea germinal. Dentro de éstos, el grupo del doctor Horacio Merchant Larios, en el Instituto de Investigaciones Biomédicas, con una trayectoria de más de 25 años, ha hecho importantes contribuciones al conocimiento de las bases celulares y moleculares de la determinación sexual de la gónada en diversos grupos de organismos. El grupo de la doctora Koffman Alfaro, del Hospital General y la Facultad de Medicina de la Universidad Nacional Autónoma de México (unam), estudia diversos desórdenes genéticos asociados a la determinación sexual en humanos. El grupo de la doctora Narváez, en la Facultad de Ciencias de la Universidad Autónoma del Estado de México, estudia los mecanismos celulares y moleculares que dirigen el desarrollo de los conductos sexuales, y los grupos de la doctora Lomelí en el Instituto de Biotecnología de la unam y el de la doctora Escalante-Alcalde en el Instituto de Fisiología Celular de la unam estudian el efecto de la deficiencia o incremento de expresión de proteínas en el desarrollo de la línea germinal de mamíferos empleando modelos transgénicos (ratones genéticamente modificados).
| El grupo del doctor Horacio Merchant Larios, en el Instituto de Investigaciones Biomédicas, con una trayectoria de más de 25 años, ha hecho importantes contribuciones al conocimiento de las bases celulares y moleculares de la determinación sexual de la gónada en diversos grupos de organismos |
Existen organismos, como la mosca de la fruta o los gusanos nemátodos en los que se conoce con mucho detalle cómo se lleva a cabo la determinación sexual y el establecimiento de la línea germinal. En este aspecto, el conocimiento en mamíferos ha estado un poco rezagado; sin embargo, en los últimos años ha habido grandes avances en el entendimiento de la determinación sexual y el establecimiento de la línea germinal en ratón gracias al desarrollo de nuevos enfoques experimentales. Por este motivo, esperamos un futuro excitante en esta área del conocimiento a nivel mundial a corto plazo.
Bibliografía
Anderson, R., R. Fassler, E. Georges-Labouesse, R. O. Hynes, B. L. Bader, J. A. Kreidberg, K. Schaible, J. Heasman y C. Wylie (1999), “Mouse primordial germ cells lacking beta1 integrins enter the germline but fail to migrate normally to the gonads”, Development 126, 1655-1664.
Kinashi, T. y T. A. Springer (1994), “Steel factor and c-kit regulate cell-matrix adhesion”, Blood 83, 1033-1038.
Koopman, P., J. Gubbay, N. Vivian, P. Goodfellow y R. Lovell-Badge (1991), “Male development of chromosomally female mice transgenic for Sry”, Nature 351, 117-121.
Meeks, J. J., J. Weiss y J. L. Jameson (2003), “Dax1 is required for testis determination”, Nature Genetics 34, 32-33.
Molyneaux, K. A., H. Zinszner, P. S. Kunwar, K. Schaible, J. Stebler, M. J. Sunshine, W. O’Brien, E. Raz, D. Littman, C. Wylie y R. Lehmann (2003), “The chemokine SDF1/CXCL12 and its receptor CXCR4 regulate mouse germ cell migration and survival”, Development 130, 4279-4286.
Moreno-Mendoza, N., V. R. Harley y H. Merchant-Larios (1999), “Differential expression of SOX9 in gonads of the sea turtle Lepidochelys olivacea at male- or female-promoting temperatures”, J Exp Zool 284, 705-710.
Ohe, K., E. Lalli y P. Sassone-Corsi (2002), “A direct role of Sry and Sox proteins in pre-mrna splicing”, PNAS USA 99, 1146-1151.
Raymond, C. S., M. W. Murphy, M. G. O’Sullivan, V. J. Bardwell, y D. Zarkower (2000), “Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation”, Genes & Development 14, 2587-2595.
Swain, A., V. Narváez, P. Burgoyne, G. Camerino y R. Lovell-Badge (1998), “Dax1 antagonizes Sry action in mammalian sex determination”, Nature 391, 761-767.
Ying, Y., X. Qi y G. Q. Zhao (2001), “Induction of primordial germ cells from murine epiblasts by synergistic action of BMP4 and BMP8B signaling pathways”, PNAS USA 98, 7858-7862.
Diana Escalante-Alcalde es doctora en investigación biomédica básica y se especializa en las áreas de la biología del desarrollo y manipulación genética, sobre la cual ha publicado numerosos trabajos en revistas internacionales. Actualmente se desempeña como investigadora en el Instituto de Fisiología Celular de la unam.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Verónica M. Narváez Padilla es doctora en biología del desarrollo, especializada en la determinación sexual. Estudia aspectos moleculares de la determinación sexual, así como el papel de la muerte celular programada en el desarrollo. Actualmente es la directora de la Facultad Ciencias de la Universidad Autónoma del Estado de México.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.