Número actual.
Enero-Marzo 2026 vol. 77-1
Portada
Desde el Comité Editorial
Embarazo adolescente, una visión integral
El embarazo adolescente es un asunto de la familia, la escuela y el Estado
El papel de la dinámica familiar en el embarazo adolescente
La búsqueda de afecto y familia en el contexto del embarazo adolescente
Transformación de la identidad en el embarazo adolescente
Hormonas, metabolismo y bioquímica durante el embarazo de una adolescente
Las barreras que dificultan una buena lactancia en madres adolescentes
La importancia de la salud bucodental durante el embarazo de las adolescentes
Alimentación y hábitos saludables en las adolescentes embarazadas
La programación de la vida desde el vientre: nutrición, genética y epigenética
Mitos comunes sobre la anticoncepción tras el embarazo adolescente
Microorganismos que ayudan a descontaminar agua con arsénico
Marcadores moleculares del ADN: huellas genéticas que revelan secretos de los seres vivos
Noticias de la Academia Mexicana de Ciencias
La degradación ambiental de la Cuenca del Alto Atoyac y su impacto en la salud
Indice
Artículos del número anterior.
Las suculentas y la vista, una relación inesperada
Noticias de la Academia Mexicana de Ciencias
Desde las redes
Innovaciones tecnológicas en la uam: una mirada desde el doctorado
Tejiendo el futuro: nanotecnología en la industria textil
Las emociones en la toma de decisiones
Una nueva terapia para la leucemia linfoblástica aguda
Linfocitos T: desarrollo, activación y funciones
Paracetamol, un analgésico popular que no es tan inocuo
Entendiendo el tormento de la cefalea en racimos
“Obesos sanos”, un término equivocado
¿Nos predisponen los genes al consumo de drogas?
El rábano: de lo comestible a lo nanotecnológico
Portada
El romero, una planta para el alivio del dolor
Alfred Wallace: científico y militante social
¿Cómo reducir los gases de efecto invernadero de los rumiantes?
La Sierra de Guadalupe, una fuente de biodiversidad en la Cuenca de México
La unión hace la fuerza: historia de los líquenes
Los dientes, una importante fuente de información morfológica y ecológica
Tejer o no tejer... Las diversas estrategias de caza de las arañas
El control de la temperatura corporal: cuestión de vida o muerte
Relojes moleculares: ¿cuándo aparecieron las especies?
Desde el Comité Editorial
Indice
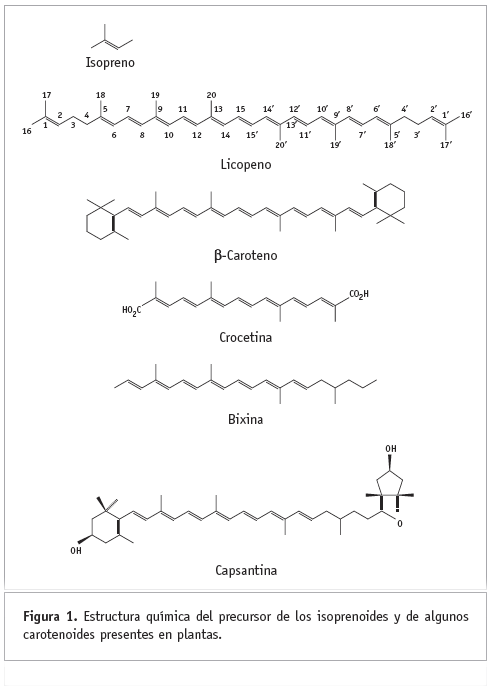
Las plantas producen aproximadamente más de 30 mil diferentes clases de compuestos conocidos como terpenoides o isoprenoides, los cuales están formados por dos, tres o más unidades estructurales de cinco átomos de carbono llamadas isopreno (Figura 1). Muchos de estos compuestos tienen aplicaciones en la manufactura de alimentos, compuestos industriales y farmacéuticos, por lo que el gran número de isoprenoides ofrece un atractivo potencial para la ingeniería genética (Broun y Somerville, 2001). Entre los isoprenoides destacan los carotenoides, los cuales comprenden a los carotenos y a las xantofilas y son producidos por bacterias, algas, hongos y plantas superiores. Aunque existen carotenoides con 30, 45 o 50 átomos de carbono, los de 40 átomos de carbono representan la mayoría de las más de 600 estructuras conocidas; los de origen bacteriano son los más diversos. Estructuralmente, los carotenoides consisten de ocho unidades de isopreno y son hidrocarburos que pueden ser lineales o con anillos cíclicos en uno o en ambos extremos terminales de la cadena hidrocarbonada. Pueden presentar grupos oxo, hidroxi y epoxi en diferentes posiciones (Figura 1). La cadena de poliisopreno consiste de más de 15 dobles enlaces conjugados, y éstos son responsables de sus colores característicos, sus propiedades fotoquímicas y de su acción biológica (Bramley, 1997).
Funciones de los carotenoides en plantas
Los carotenoides son comunes en todos los organismos fotosintéticos y desempeñan funciones importantes en todos los niveles taxonómicos. Participan en la fotosíntesis y abundan en los cloroplastos, donde son constituyentes del complejo proteína-pigmento en asociación con la clorofila. Los carotenoides protegen al aparato fotosintético del deterioro de las reacciones oxidativas, especialmente las que ocurren cuando hay estrés causado por luz (Broun y Sommerville, 2001). Se acumulan en los organelos llamados cromoplastos y dan lugar a los colores amarillo, naranja y rojo de muchas flores, frutos y raíces de almacenamiento. En la actualidad no existe evidencia firme de la función de los carotenoides en flores, raíces y frutos, aunque se considera que probablemente estén involucrados en la formación del polen (ya que han sido encontrados carotenoides llamados lipocromos en el polen de plantas como Verbascum thapsiforme, Salis alba, S. nigricans, Lilium candidum y Taraxacum officinale; su significado biológico aún no ha sido investigado) y en la atracción de los polinizadores involucrados en la dispersión de las semillas (Misawa y colaboradores,1994).
 |
| En la actualidad no existe evidencia firme de la función de los carotenoides en flores, raíces y frutos, aunque se considera que probablemente estén involucrados en la formación del polen y en la atracción de los polinizadores involucrados en la dispersión de las semillas |
Importancia de los carotenoides en la dieta
 Los vertebrados no pueden sintetizar carotenoides, por lo que dependen de los que ingieren en su dieta para producir sus retinoides, como el retinal (el principal pigmento visual), el retinol (vitamina A) y el ácido retinoico (sustancia que controla el desarrollo embrionario en humanos). El principal precursor de los retinoides es el ß-caroteno, que contiene dos anillos de ß-ionona en los extremos de la molécula (Figura 1). El ß-caroteno es convertido a retinal por medio de la enzima dioxigenasa (Römer y colaboradores, 2000). Otros carotenoides son convertidos a vitamina A por los humanos y son necesarios para el crecimiento y el desarrollo, además protegen contra las cataratas y su insuficiencia en la dieta causa xeroftalmia, ceguera y muerte prematura (Bramley, 2002; Römer y colaboradores, 2000). Algunos carotenoides se distinguen por su protección contra el cáncer, promoviendo respuestas inmunitarias, tanto antioxidantes como fotoprotectoras (Burkhardt y colaboradores, 2001), y evitan la reducción de condiciones crónicas tales como enfermedades cardiacas coronarias y degeneración macular (Römer y colaboradores, 2000).
Los vertebrados no pueden sintetizar carotenoides, por lo que dependen de los que ingieren en su dieta para producir sus retinoides, como el retinal (el principal pigmento visual), el retinol (vitamina A) y el ácido retinoico (sustancia que controla el desarrollo embrionario en humanos). El principal precursor de los retinoides es el ß-caroteno, que contiene dos anillos de ß-ionona en los extremos de la molécula (Figura 1). El ß-caroteno es convertido a retinal por medio de la enzima dioxigenasa (Römer y colaboradores, 2000). Otros carotenoides son convertidos a vitamina A por los humanos y son necesarios para el crecimiento y el desarrollo, además protegen contra las cataratas y su insuficiencia en la dieta causa xeroftalmia, ceguera y muerte prematura (Bramley, 2002; Römer y colaboradores, 2000). Algunos carotenoides se distinguen por su protección contra el cáncer, promoviendo respuestas inmunitarias, tanto antioxidantes como fotoprotectoras (Burkhardt y colaboradores, 2001), y evitan la reducción de condiciones crónicas tales como enfermedades cardiacas coronarias y degeneración macular (Römer y colaboradores, 2000).
Los carotenoides son compuestos nutricionales y antioxidantes naturales que al ser absorbidos a través de la dieta por ciertos animales, son metabolizados y convertidos en otros compuestos, que son responsables del color de animales como la langosta, los flamencos y peces como el salmón (Ye y colaboradores, 2000).
 Otros usos de los carotenoides
Otros usos de los carotenoides
En la industria avícola, la flor del cempasúchil (Tagetes erecta) se emplea principalmente para colorear la piel de las aves y la yema de los huevos, mientras que la pasta de achiote que se obtiene de Bixa orellana se utiliza como colorante en platillos típicos de la cocina yucateca como la cochinita pibil y el pollo pibil. La crocetina, obtenida del azafrán (Crocus sativus) se emplea para colorear el arroz y en otros platillos típicos españoles. Carotenoides como la astaxantina se emplean en acuacultura para el cultivo de camarones y salmones (Schewmarker y colaboradores, 1999). En la actualidad, algunos carotenoides son utilizados en productos de belleza como cremas y champús, y en productos para el cuidado de la piel.
Carotenoides de importancia comercial y sus fuentes principales
Entre los carotenoides de importancia comercial se encuentran la crocetina, presente en el azafrán; la astaxantina presente en microalgas como Dunaliella y Haematococcus pluvialis, el licopeno del tomate (Lycopersicon esculentum), el ß-caroteno de zanahorias y chile (Capsicum), el ß-caroteno, luteína, zeaxantina y fitoeno del cempasúchil (Figura 2), (Mann y colaboradores, 2000) y la bixina del achiote. Actualmente, sólo unos cuantos carotenoides (ß-caroteno, licopeno, astaxantina, cantaxantina, capsantina, luteína, bixina, ß-apo-8-carotenal y el éster del ß-apo-8-carotenal) pueden ser producidos de manera comercial por medio de síntesis química, fermentación de algunos microorganismos o de aislamiento de un pequeño número de fuentes naturales (Figura 3). Su venta como alimentos y como suplementos alimenticios se ha estimado en aproximadamente 500 millones de dólares, y el mercado se está incrementando.
Existen carotenoides cuya fuente exclusiva son plantas y no microorganismos; entre ellos se encuentran la bixina del achiote, la crocetina del azafrán, la capsantina de especies de chiles y la zeaxantina del maíz (Zea mays). El contenido de bixina fluctúa entre 1 y 6.9 por ciento del peso seco de la semilla de achiote; la capsantina representa cerca de 587.7 microgramos por gramo de peso fresco de Capsicum, la zeaxantina puede alcanzar entre 0.6 y 71.9 microgramos por gramo de peso fresco del maíz, y se requieren de 4 mil estigmas para obtener 25 gramos de azafrán. También se pueden obtener otros carotenoides en abundancia de otras especies vegetales, como la luteína de los pétalos de la flor del cempasúchil, en los que puede alcanzar hasta 5 mil 700 microgramos por gramo de peso seco (Mann y colaboradores, 2000), mientras que el contenido de ß-caroteno de zanahorias puede alcanzar niveles de 60 a 470 microgramos por gramo de peso fresco.
Síntesis química de carotenoides versus fuentes naturales
La estructura química de un carotenoide se caracteriza por poseer un largo sistema de dobles enlaces conjugados en la parte central, de forma que el arreglo de las unidades está revertido al centro de la molécula (Figura 1), (Fraser y colaboradores, 2000). Debido al sistema de dobles enlaces conjugados en la molécula del carotenoide, existen un gran número de isómeros geométricos (isómeros cis/trans), (Bramley, 2002). Además, como los carotenoides poseen centros quirales, pueden existir en diferentes configuraciones (estereoisómeros). Por ejemplo, la astaxantina (que posee dos centros quirales idénticos), obtenida por síntesis química, existe como una mezcla de tres estereoisómeros configuracionales. Por otra parte, la industria dedicada a la producción de alimentos para granjas acuícolas tiene renuencia a utilizar carotenoides cuya configuración sea opuesta a la encontrada de manera natural.
Manipulación genética de carotenoides
 Las primeras investigaciones sobre la manipulación genética de carotenoides se realizaron inicialmente en microorganismos y estuvieron dirigidas a identificar y aislar los genes involucrados en su ruta de biosíntesis, como en la bacteria epifítica Erwinia y la bacteria marina Agrobacterium aurantiacum (Misawa y colaboradores, 1993). Posteriormente, estos genes han sido clonados en hospederos como levaduras que no fabrican carotenoides (Candida utilis y Saccharomyces cerevisiae), y especialmente en la bacteria Escherichia coli para la producción de carotenoides como licopeno, ß-caroteno y astaxantina (Fray y colaboradores, 2001b).
Las primeras investigaciones sobre la manipulación genética de carotenoides se realizaron inicialmente en microorganismos y estuvieron dirigidas a identificar y aislar los genes involucrados en su ruta de biosíntesis, como en la bacteria epifítica Erwinia y la bacteria marina Agrobacterium aurantiacum (Misawa y colaboradores, 1993). Posteriormente, estos genes han sido clonados en hospederos como levaduras que no fabrican carotenoides (Candida utilis y Saccharomyces cerevisiae), y especialmente en la bacteria Escherichia coli para la producción de carotenoides como licopeno, ß-caroteno y astaxantina (Fray y colaboradores, 2001b).
Finalmente, con los avances obtenidos en la transformación genética de plantas, estos genes de origen microbiano e incluso con genes de origen vegetal fueron introducidos en plantas de interés agronómico.
Éxitos en la manipulación genética de la vía de los carotenoides en plantas superiores
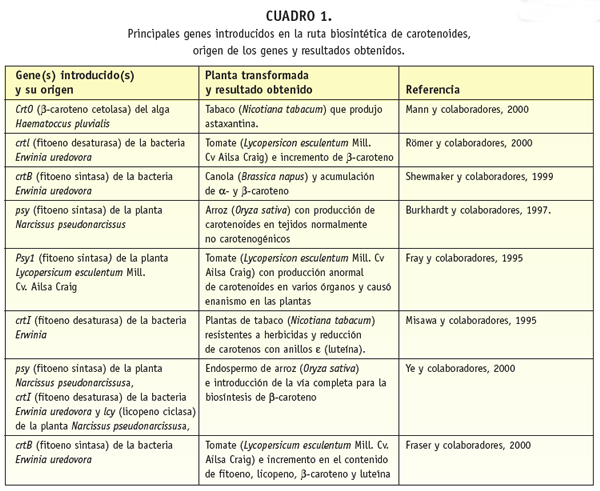
Entre los éxitos obtenidos está el logrado en las semillas de canola (Brassica napus), que normalmente contienen cantidades mínimas de ß-caroteno. La simple sobreexpresión del gen que codifica para la enzima fitoeno sintasa de origen bacteriano (crtB) fusionado a la secuencia codificante para el péptido de tránsito de la subunidad pequeña de la ribulosa-1,5-bifosfato carboxilasa/oxigenasa (Rubisco) de chícharo, enzima clave en la fotosíntesis y la fotorrespiración, cuya subunidad pequeña es codificada en el ácido desoxirribonucleico (adn) nuclear, con una secuencia adicional para un péptido de tránsito que le permite ser transportada al cloroplasto (Misawa y colaboradores, 1993) bajo el control de un promotor específico de semilla (napin), fue suficiente para incrementar 300 veces la concentración de ß-caroteno (Cuadro 1), un nivel similar al encontrado en el aceite de palma (Shewmaker y colaboradores, 1995).
Los tomates acumulan licopeno y una cantidad variable de ß-caroteno (dependiendo de la variedad y la estación del año), por lo que los primeros experimentos de manipulación genética se orientaron a la sobreexpresión de los genes que codifican para las primeras enzimas de la ruta de biosíntesis (fitoeno sintasa y fitoeno desaturasa). Sobreexpresando el producto del gen de la fitoeno desaturasa de origen bacteriano (crtl) no se elevaron los niveles de carotenoides totales, pero el contenido de ß-caroteno (Cuadro 1) se incrementó por arriba del 45 por ciento (Römer y colaboradores, 2000).

El gen CrtO del alga H. pluvialis, que codifica para la enzima ß-caroteno cetolasa, fue transferido a plantas de Nicotiana tabacum (que no producen astaxantina) bajo la regulación del promotor de la enzima fitoeno desaturasa (Pds) de tomate para la expresión específica en flores y frutos. Se utilizó la secuencia codificante para el péptido de tránsito del Pds de tomate para dirigir el polipéptido CrtO a los plástidos. Los nectarios transformados acumularon cetocarotenoides como la astaxantina (Mann y colaboradores, 2000), con lo que se demostró por primera vez que las plantas superiores podrían ser utilizadas como una fuente potencial de nuevos pigmentos carotenoides (Cuadro 1).
Uno de los logros más espectaculares fue la introducción de la vía completa para la biosíntesis de ß-caroteno en el endospermo de arroz (Oryza sativa). Los granos de arroz carecen de carotenoides, por lo que la manipulación genética para la formación de ?-caroteno en el endospermo del arroz debía incluir al menos cuatro reacciones catalizadas por las enzimas fitoeno sintasa, fitoeno desaturasa, ?-caroteno desaturasa y licopeno ciclasa. La introducción de los genes se realizó con un plásmido que contenía un gen de narciso (Narcissus pseudonarcissus) que codifica para la fitoeno sintasa y el gen que codifica para la fitoeno desaturasa de la bacteria Erwinia uredovora; estas dos enzimas participan en la síntesis del licopeno a partir del geranilgeranil pirofosfato. Ambos genes fueron complementados con las secuencias de tránsito para dirigirlos a los plástidos del endospermo. El gen de la fitoeno sintasa (psy) estuvo bajo el control del promotor de la glutelina específica del endospermo, y el gen bacteriano que codifica para la fitoeno desaturasa (crtI) (que también cataliza la reacción de la ?-caroteno desaturasa) bajo el control del promotor constitutivo 35S del virus del mosaico de la coliflor. Se acumularon carotenoides como luteína, zeaxantina, a y ß-caroteno en lugar de licopeno (Cuadro 1). Para completar la vía biosintética del ß-caroteno se introdujo también el gen de la ß-licopeno ciclasa (lcy) de narciso bajo el control del promotor 35S del virus del mosaico de la coliflor, lo que incrementó los niveles del contenido de ß-caroteno del endospermo de arroz hasta un nivel de 1.6 microgramos por gramo de peso seco (Ye y colaboradores, 2000; Sandmann, 2001b). Se demostró así que es posible la producción de carotenoides en tejidos que normalmente no los producen (Cuadro 1), siempre que se tengan disponibles los precursores (Burkhardt y colaboradores, 1997).
También al introducir en la planta Arabidopsis thaliana el gen que codifica para la 1-desoxi-D-xilulosa-5-fosfato sintasa (CLA1), enzima que cataliza los primeros pasos en la vía de la MEP, se obtuvo un ligero incremento en el contenido de carotenoides totales (aproximadamente 12-31%), aunque vale la pena aclarar que A. thaliana es una planta simplemente utilizada como modelo de estudio y no tiene realmente importancia económica por el nivel de carotenoides que produce.
Por último, al sobreexpresar el gen de la bacteria E. uredevora que codifica para la fitoeno sintasa (crtB) en tomate (Lycopersicum esculentum Mill. cv. Ailsa Craig) se logró la expresión específica en el fruto, empleando el promotor de la enzima poligalacturonasa de tomate, de tal forma que la proteína fue dirigida al cromoplasto por la secuencia de tránsito de la fitoeno sintasa-1. Se incrementó de 2 a 4 veces el contenido de los carotenoides totales con respecto a los controles, mientras que los niveles de fitoeno, licopeno, ß-caroteno y luteína se incrementaron 2.4, 1.8, 2.0 y 2.2 veces, respectivamente (Fraser y colaboradores, 2000).
 Intentos no exitosos en la manipulación genética de la vía de los carotenoides en plantas superiores
Intentos no exitosos en la manipulación genética de la vía de los carotenoides en plantas superiores
No todas las manipulaciones genéticas de la ruta metabólica de los carotenoides han sido exitosas, ya que se han presentado algunas limitaciones, como la observada cuando se sobreexpresó el gene de la Psy1 de jitomate en plantas de jitomate bajo el control del promotor constitutivo 35S del virus del mosaico de la coliflor, que causó una producción excesiva (anormal) de carotenoides en cotiledones, cubierta de las semillas, frutos y en zonas de abscisión. También se presentó una reducción en la altura de las plantas, debido a la reducción en algunos reguladores biológicos llamados giberelinas, incluyendo la giberelina GA1 (activa biológicamente). Se logró determinar que al sobreexpresar el gen se alteró el flujo de la ruta de biosíntesis de los isoprenoides, ya que aunque se obtuvieron niveles elevados de licopeno a expensas de la síntesis del ent-kaureno, se redujeron los niveles de GA, lo que produjo plantas enanas (Cuadro 1). Su altura se restauró parcialmente cuando fueron tratadas con giberelina (Fray y colaboradores,1995).
Por otra parte, cuando se sobreexpresaron los genes que codifican para la enzima fitoeno sintasa (psy1 y psy2) de tabaco (Nicotiana tabacum cv Petit Havana SR1) y la fitoeno desaturasa (pds) Nicotiana benthamiana, bajo el control del promotor 35S del virus del mosaico de la coliflor, las plantas obtenidas presentaron enanismo y un ligero incremento en el contenido de carotenoides totales (27 por ciento).
| En otras especies vegetales será necesario introducir varios genes para aumentar en forma simultánea la actividad de múltiples enzimas y con ello el flujo a través de la vía metabólica y repercutir en el incremento de la concentración de carotenoides |
Conclusiones
La manipulación de los genes estructurales de la biosíntesis de carotenoides se ha centrado en los genes de las enzimas iniciales de la ruta. Como ejemplo tenemos la sobrexpresión del gen que codifica para la enzima fitoeno sintasa, la cual cataliza el primer paso en la biosíntesis de carotenoides al unir las dos moléculas de geranilgeranil pirofosfato para formar el fitoeno, con la que se han obtenido resultados bioquímicos diversos dependiendo de la especie y del tipo de promotor empleado en la expresión del gen. Ello pone de manifiesto lo inadecuado de emplear promotores constitutivos o inespecíficos (35S del virus del mosaico de la coliflor) si se pretende aumentar el contenido de carotenoides en una especie (Broun y Somerville, 2001). Por otra parte, aunque la simple expresión de un solo gen de una enzima de las etapas iniciales puede mejorar el flujo a través de la vía metabólica, tal vez también se requiera manipular los pasos múltiples para obtener un aumento neto en la acumulación del producto y evitar con ello el control multigénico (Fraser y colaboradores, 2000). El principio del control multigénico del flujo es ilustrado por el trabajo de Ye y colaboradores (2000) sobre el incremento en la acumulación de carotenoides en arroz, en el que se introdujeron tres genes simultáneamente para obtener el éxito esperado. Lo anterior sugiere que tal vez en otras especies vegetales será necesario introducir varios genes para aumentar en forma simultánea la actividad de múltiples enzimas y con ello el flujo a través de la vía metabólica y repercutir en el incremento de la concentración de carotenoides. Se ha propuesto que las enzimas carotenogénicas están presentes en agregados multienzimáticos, por lo que la alteración de los niveles de algunas de las enzimas podría afectar la actividad de las otras enzimas del complejo. Esta hipótesis podría explicar el incremento observado en los niveles de ß-caroteno encontrados durante la sobreexpresión de crtl en arroz (Ye y colaboradores, 2000) o tomate (Römer y colaboradores, 2000).
Los mejores éxitos se han obtenido cuando los genes de bacterias, algas o plantas son colocados bajo el control de promotores específicos para tejidos u órganos para ser expresados en una etapa específica del desarrollo de la planta (como el promotor de la fitoeno desaturasa del tomate para la expresión específica en flores y frutos; el específico de semilla de Brassica napus, el promotor de la poligalacturonasa de tomate para la expresión específica en fruto y así mejorar la expresión del gen en la fase de maduración, etcétera), (Bramley, 2002).
Aunque la producción natural de algunos pigmentos carotenoides por medio de ingeniería genética a partir de microorganismos es una realidad, los rendimientos obtenidos son menores a los obtenidos en plantas. Lo anterior se debe a que las bacterias, levaduras y hongos presentan una capacidad de almacenamiento inadecuada para la mayoría de los compuestos producidos, ya que carecen de las estructuras especializadas, por lo que no son capaces de secuestrar los carotenoides, los cuales pueden dañar sus membranas celulares cuando están presentes en concentraciones elevadas (Mann y colaboradores, 2000).
La razón de que las plantas y algas acumulen carotenoides en concentraciones que son 10 o 15 veces más elevadas que la de los microorganismos es que además poseen mecanismos especiales para su almacenamiento en vesículas o glóbulos de lípidos en los plástidos (Mann y colaboradores, 2000) y proteínas asociadas en su secuestración. En términos evolutivos, esas proteínas podrían ser parte de un programa más global de estabilización de la membrana del plástido.
| A largo plazo, la investigación sobre la manipulación genética para la sobreproducción de carotenoides en plantas se concentrará a entender cómo están regulados los genes para la fabricación de carotenoides en plantas superiores |
 Perspectivas
Perspectivas
La manipulación genética de la vía de biosíntesis de carotenoides ha sido realizada en sistemas de producción microbianos y en cultivos agrícolas para incrementar y modificar la acumulación de carotenoides o para la producción de carotenoides que normalmente no se fabrican en los microorganismos o en la planta. Consideramos que los estudios a corto plazo estarán dirigidos a la introducción de genes carotenogénicos en nuevos hospederos para la producción de carotenoides con mayor actividad antioxidante, o a la introducción de genes específicos, como el que codifica para la ß-caroteno cetolasa (CrtO) de algas para modificar el patrón de producción de carotenoides en plantas (Mann y colaboradores, 2000). Por ejemplo, podría introducirse el gen CrtO en plantas como Tagetes erecta o Bixa orellana y probablemente producir astaxantina, que tiene mayor valor agregado que la zeaxantina, la luteína y la bixina.
También podrían introducirse genes carotenogénicos específicos o en combinación con otros genes para maximizar la vía metabólica en variedades nativas con bajo contenido de carotenoides. A largo plazo, la investigación sobre la manipulación genética para la sobreproducción de carotenoides en plantas se concentrará a entender cómo están regulados los genes para la fabricación de carotenoides en plantas superiores, a aclarar el funcionamiento de las enzimas que fabrican carotenoides y los complejos que los almacenan. Seguramente se profundizará en estudios sobre la función de las proteínas asociadas a carotenoides y se realizarán trabajos de transformación simultánea con los genes carotenogénicos estructurales y los genes que se logren aislar y que codifiquen para las proteínas involucradas en el almacenamiento y la secuestración de los carotenoides.
Agradecimientos
Este trabajo fue financiado por el Consejo Nacional de Ciencia y Tecnología (Conacyt) con el proyecto No. 28643-B y la beca de doctorado de Juan Manuel Zaldívar Cruz (No. 66872). Los autores agradecen a la química farmacobióloga Elidé Avilés Berzunza las fotografías de las fuentes naturales de carotenoides.
Bibliografía
Bramley, P. (2002), “Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit-specific manner”, Proc. Natl. Acad. Sci. USA 99(2):1092-1097.
Broun, P. y C. Somerville (2001), “Progress in plant metabolic engineering”, Proc. Natl. Acad. Sci. USA 98(16):8925-8927.
Burkhardt, P. Beyer, J. Wün, A. Klöti, G. Armstrong, M. Schledz, J. Von Lintig e I. Potrykus (1997), “Transgenic rice (Oryza sativa) endosperm expressing daffodil (Narcissus pseudonarcissus) phytoene synthase accumulates phytoene, a key intermediate of provitamin biosynthesis”, Plant J. 11(5):1071-1078.
Fraser, P., S. Romer, C. Shipton, P. Mills, J. Kiano, N. Misawa, R. Drake, W. Schuch y G. Giuliano, R. Aquilani y S. Dharmapuri (2000), “Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit manner”, Proc. Natl. Acad. Sci. USA 99(2):1092-1097.
Fray, R., A. Wallace, P. Fraser, D. Valero, P. Hedden, P. Bramley y D. Grierson (1995), “Constitutive expression of a fruit phytoene synthase gene in transgenic tomatoes causes dwarfism by redirecting metabolites from the gibberellin pathway”, Plant J. 8(5):693-701.
Mann, V., M. Harker, I. Pecker y J. Hirschberg (2000), “Metabolic engineering of astaxanthin production in tobacco flowers”, Nat. Biotechnol. 18:888-892.
Misawa, N., K. Masamoto, T. Hori, T. Ohtani, P. Böger y G. Sandmann (1994), “Expression of an Erwinia phytoene desaturase gene not only confers multiple resistance to herbicides interfering with carotenoid biosynthesis but also alters xanthophyll metabolism in transgenic plants”, Plant J. 8:481-489.
Römer, S., P. Fraser, J. Kiano, C. Shipton, N. Misawa, W. Schuch y P. Bramley (2000), “Elevation of the provitamin A content of transgenic tomato plants”, Trends Biotech. 18:666-669.
Schewmarker, C., J. Sheehy, M. Daley, S. Colburn y D. Yang-Ke (1999), “Seed-especific overexpression of phytoene synthase: increase in carotenoids and other metabolic effects”, Plant J. 20:401-412.
Ye, X., S. Al-Babili, A. Klöti, J. Zhang, P. Lucca, P. Beyer e I. Potrikus (2000), “Engineering the provitamin A (ß-caroteno) biosynthetic pathway into (carotenoid-free) rice endosperm”, Science. 287:303-305.
Juan Manuel Zaldívar-Cruz realizó su tesis doctoral sobre la transformación genética del achiote, bajo la dirección del doctor Gregorio Godoy-Hernández en la Unidad de Bioquímica y Biología Molecular de Plantas del Centro de Investigación Científica de Yucatán, A.C. En 2005 obtuvo el grado de doctor en ciencias y biotecnología de plantas. Actualmente es profesor investigador en el área de Ciencias de Alimentos e Ingeniería del Colegio de Postgraduados, campus Tabasco. Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo..
Gregorio Godoy-Hernández es doctor en biotecnología de plantas por el Departamento de Ingeniería Genética del Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional-Unidad Irapuato Guanajuato (1997). Actualmente es investigador en la Unidad de Bioquímica y Biología Molecular de Plantas del Centro de Investigación Científica de Yuca- tán (cicy). Realiza micropropagación y transformación genética de plantas de interés agroindustrial. Es profesor en la maestría y el doctorado en biotecnología de plantas que imparte el cicy. Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.






